wiki
What is a wiki?
A wiki is a web-based collaborative platform that enables users to store, create and modify content in an organized manner. The term comes from the word wiki wiki, which means fast in Hawaiian.
What are wikis used for?
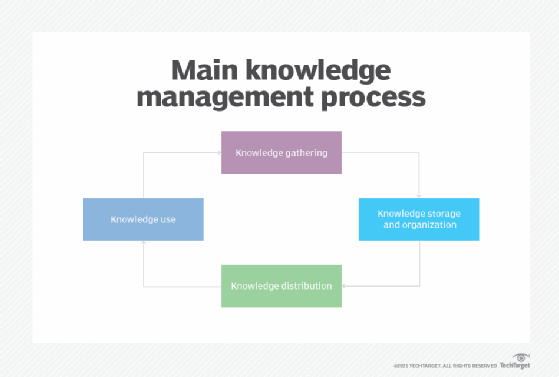
Wikis are commonly used for knowledge management, project collaboration and intranet applications. They are a great resource for businesses, teams and individuals who need to share information quickly and efficiently.
Wikis provide the ability to link related pages of information together using hyperlinks, which makes them ideal for creating connected networks of data. This provides an easy way to organize information, making it easier for users to access the data they need.
Besides business use, wikis have become popular among fan communities who create their own wiki websites to document their fandoms and share information. This can be seen in the increasing number of wiki-based fan websites dedicated to movies, books, TV shows and celebrities.
The best-known example of a wiki website is Wikipedia.

Common wiki features
Some common wiki features include page comments, search functions and discussion forums. Additionally, wiki software packages often enable file uploading and version control so that users can track the progress of their projects.
Do you need coding knowledge to use a wiki?
Users do not need know how to code to use a wiki. Most wiki platforms are designed to be easy to use and require no coding knowledge. They come with a range of features, such as search functions, templates and revision control, that make the wiki creation process simple and efficient.
By using wiki software, users can easily create new pages, upload images and documents, edit content, track changes and collaborate with others. This makes wiki platforms a great tool for businesses and teams to manage their digital knowledge resources.
Examples of wiki software
Wikis are constantly evolving, and new wiki software packages are being released all the time. Some popular examples of wiki software are the following:
- MediaWiki
- Wiki.js
- TiddlyWiki
- Nuclino
- Confluence
- Zoho Wiki
- DokuWiki
- You Need A Wiki
- Guru
- BookStack
- Slite
- GitBook
- XWiki
- Notion
- Slab
Each wiki platform provides different features, so it's important to pick the wiki software package that best suits your needs.
Check out our ultimate guide to collaboration platforms, and read about seven best practices for knowledge management strategies.
